Migliaia di pubblicazioni scientifiche e casi clinici peer-reviewed da consultare
L’eritema multiforme (EM) è una patologia infiammatoria acuta che riconosce come meccanismo eziopatogenetico una reazione autoimmunitaria contro i cheratinociti della cute e delle mucose, innescata dall’esposizione ad antigeni quanto mai vari tra i quali in particolare il virus HSV.
Molti pazienti con EM riferiscono infatti all’anamnesi un episodio di infezione erpetica, in genere labiale, entro le 2 settimane precedenti. L’EM può essere inoltre correlato con un’ampia serie di farmaci (sulfamidici, cefalosporine, aminopenicilline, chinolonici, chlormezanone, barbiturici, FANS, anticonvulsivanti, allopurinolo e contraccettivi) e con alcuni eventi precipitanti quali vaccinazioni recenti, radioterapia craniale, patologie intestinali infiammatorie, LES, GvHD, sarcoidosi, colestasi epatica, mestruazioni, prodotti cosmetici e profumi.
Eritema multiforme orale dopo vaccinazione Pfizer-BioNTech COVID-19: una segnalazione di quattro casi
” Dopo la vaccinazione, possono verificarsi effetti avversi locali e sistemici. Reazioni cutanee come orticaria, dolore locale al sito di iniezione, rash morbilliforme sono state documentate dopo la vaccinazione”.
BARI – “Segnaliamo quattro casi di riacutizzazione dell’eritema multiforme orale che si manifestano dopo la somministrazione della vaccinazione BNT162b2 (PFIZER). Tutti i pazienti hanno negato precedenti manifestazioni eritematiche ed erpetiche. Due dei casi riportati (numero 1 e 2) presentavano lesioni sia orali che cutanee, mentre i casi 3 e 4 mostravano solo manifestazioni orali. Tre dei casi hanno presentato l’eritema dopo la prima somministrazione del dosaggio della vaccinazione, solo un caso ha riportato lesioni dopo la seconda somministrazione del dosaggio della vaccinazione”[…]”Inoltre, sono stati descritti 5 casi di riattivazione del virus varicella-zoster dopo la vaccinazione BNT162b2 (PFIZER)“
Caso 1
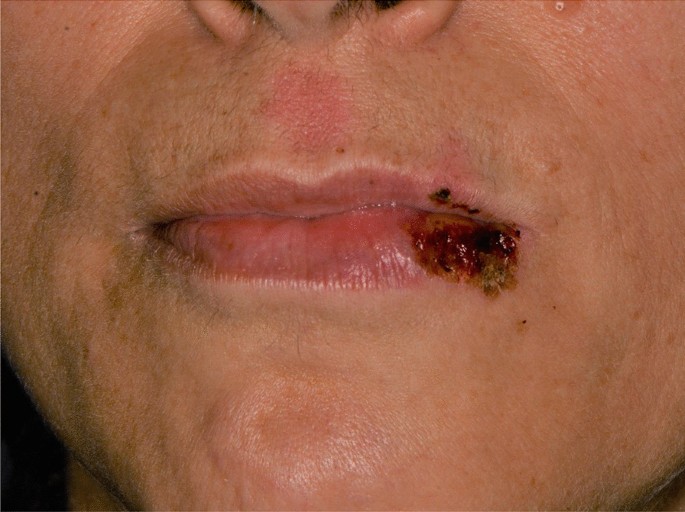
Una donna di 55 anni presentata alla sezione di Medicina Orale del Policlinico di Bari lamentava lesioni dolorose su labbra, mucosa orale, mani, ginocchia e piedi. Un anno prima, è venuta alla nostra attenzione a causa della gengivite desquamativa, che è stata successivamente diagnosticata come pemfigoide della membrana mucosa (MMP). Dopo la terapia a base di corticosteroidi, l’MMP è stato rimesso per 11 mesi.
Ventiquattro ore dopo aver ricevuto la prima dose di somministrazione del vaccino, non ha riportato alcun sintomo, tranne un lieve dolore sul sito di iniezione.
Dieci giorni dopo, il paziente ha riferito lo sviluppo di lesioni squamose croste diffuse sulla pelle labiale e vermiglio.
Successivamente, ha anche sviluppato lesioni erosive dolorose della mucosa orale e placche targetoidi concentriche su mani, avambracci, ginocchia e talloni. Le mucose genitali non sono state coinvolte. Prima della vaccinazione della prima dose, la paziente era apparentemente in ottima salute, senza alcuna storia recente di herpes labialis e lesioni MMP, e non stava assumendo alcun farmaco. Successivamente, la paziente è stata sottoposta ad una seconda dose di vaccino, sottoposta a somministrazione di corticosteroidi su consiglio del suo medico di medicina generale, per contenere la diffusione della riacutizzazione, nonostante un lieve rischio di una ridotta risposta al vaccino...Il paziente ha riportato la comparsa di nuove lesioni sulle mani immediatamente dopo la seconda dose[…]
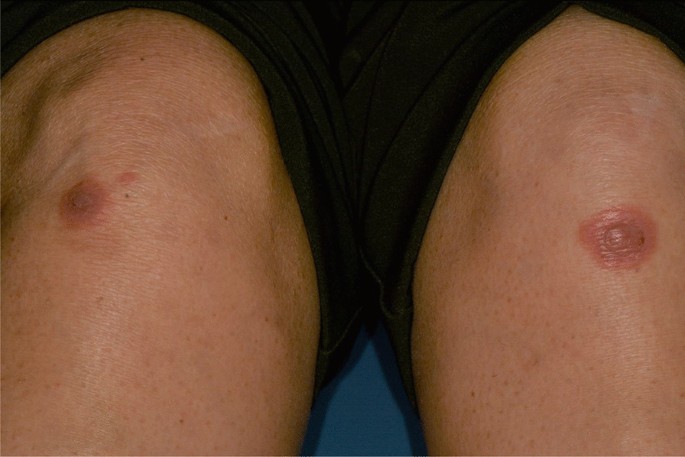
Caso 2
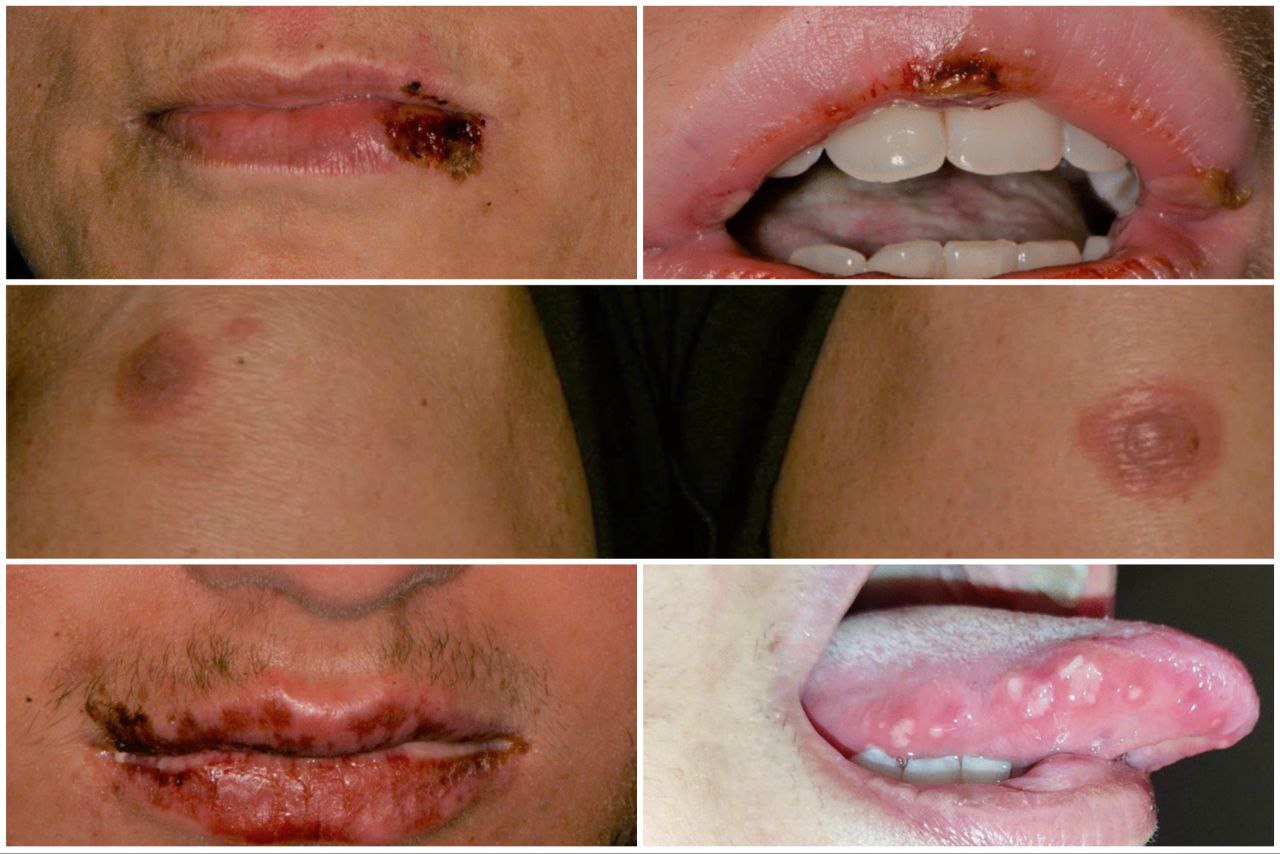
Un uomo di 15 anni affetto dalla Sindrome di West, una forma di epilessia associata a deterioramento cognitivo, ha sviluppato eritema orale, erosioni e pseudo-membrane diffuse in tutta la mucosa orale, associate a forti dolori e disfagia, 7 giorni dopo la prima dose di somministrazione di BNT162b2 (Fig. 9). Erano presenti anche lesioni cutanee multiple costituite da placche eritematose che interessano tutto il corpo, in particolare sul tronco, sulle gambe e sul collo (Fig. 10). Il quadro clinico era coerente con una diagnosi minore EM.
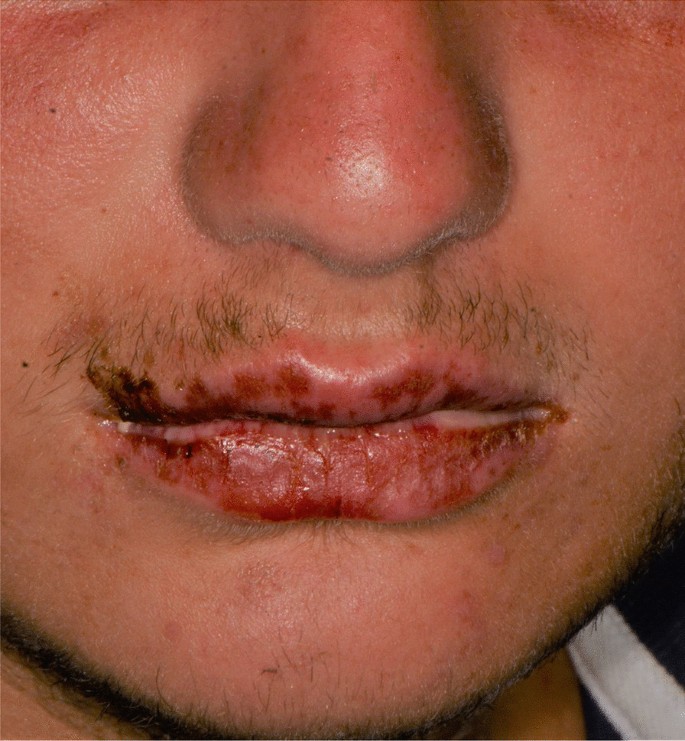
Il paziente non aveva una storia medica di malattie cutanee autoimmuni o erpetiche e non ha riportato alcun cambiamento nel suo solito trattamento medico per l’epilessia, costituito da valproato.[…]
Caso 3
Una donna di 49 anni è venuta alla nostra attenzione lamentando una sensazione di bruciore intraorale con una successiva comparsa di lesioni eritematose e bollose sulla lingua e sul pavimento della bocca, che si verificano 24 ore dopo la seconda dose di somministrazione del vaccino BNT162b2.
La paziente non ha fatto riferimento a una precedente storia di manifestazione erpetica né ad altre malattie, né stava assumendo farmaci prima della vaccinazione.
Dopo una settimana le lesioni hanno presentato un miglioramento spontaneo, ma poi sono sorte lesioni eritematose diffuse sulla lingua dorsale, sul pavimento della bocca, sulle mucose gengivali, sulla mucosa buccale e sul palato molle, causando gravi disfagia[…]
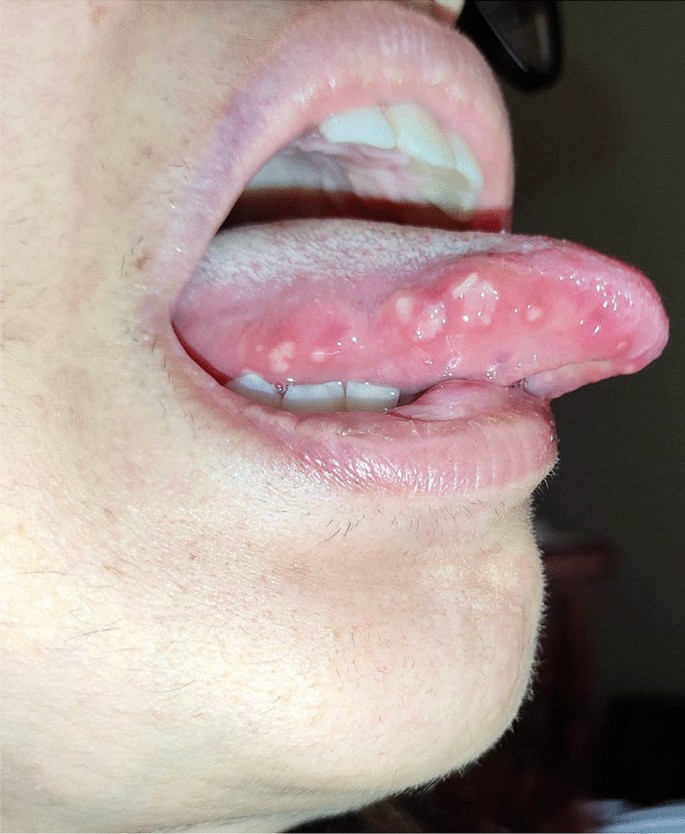
Caso 4
Una donna di 20 anni affetta da celiachia, intolleranza al lattosio e colon spastico, è stata indirizzata alla nostra attenzione 18 giorni dopo la prima dose di somministrazione del vaccino BNT162b2, lamentando dolore e sanguinamento dalla bocca, disfagia e disfonia. L’esame orale ha rivelato la presenza di erosioni sulla mucosa gengivale e delle labbra, lesioni squamose croste sulla pelle labiale e vermiglio associato a febbre persistente (39 °C) .
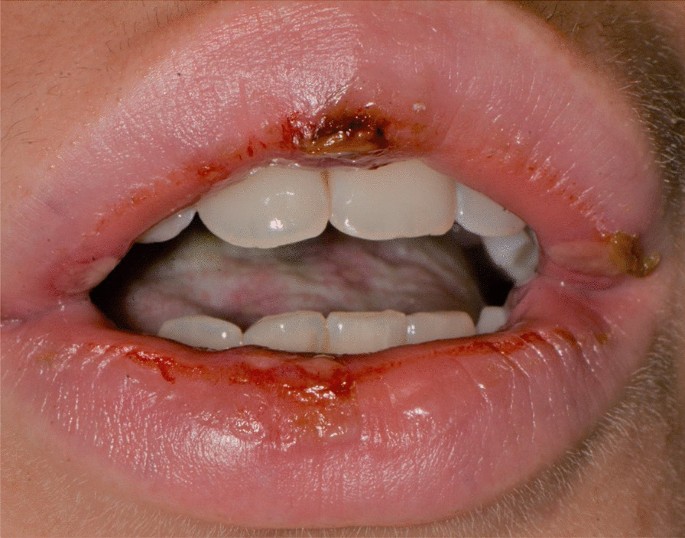
Non sono state rilevate lesioni cutanee. Ha già assunto valaciclovir e nistatina per 7 giorni senza miglioramenti. L’infezione da Covid-19 è stata esclusa a seguito di diversi tamponi rinofaringei negativi. Prednisone 25 mg p.o. dosaggio ridotto è stato prescritto per 3 settimane.
Discussione e conclusioni
I casi riportati hanno mostrato l’insorgenza di riacutizzazione EM con coinvolgimento mucoso e cutaneo entro 10 giorni dalla somministrazione del vaccino Pfizer / BioNTech COVID-19.
Nessuno dei pazienti aveva una storia di EM, sindrome di Stevens-Johnson, né riacutizzazione ricorrente del virus dell’herpes simplex. Tutti i pazienti hanno negato l’impiego di farmaci collegabili alle manifestazioni EM.
Da dicembre 2020 a febbraio 2021 sono stati segnalati 414 casi di reazioni avverse dermatologiche dei vaccini mRNA Covid-19. Tra questi, solo il 17% si è verificato dopo il vaccino Pfizer/BioNTech Covid-19. La maggior parte delle reazioni sono state limitate al sito di iniezione e si sono verificate come orticaria (0,2%), wheal nel sito di iniezione (0,2%), rash morbilliforme (0,1%). I sintomi di solito si manifestavano entro 7 giorni dall’iniezione: manifestazioni locali comparsero entro 1-3 giorni dall’inoculazione mentre reazioni sistemiche furono osservate 7-8 giorni dopo la vaccinazione [4].
La percentuale di pazienti che presentavano una reazione cutanea generalizzata ritardata (56%) ha mostrato anche rash da vaccinazione in sito locale. Tra questi, l’8,6% aveva varicella-zoster, il 3,4% herpes simplex, il 3,5% manifestazioni simili alla pitiriasi. È stata segnalata anche la riacutizzazione del lichen planus preesistente a seguito della vaccinazione BioNTech Covid-19 [7]. Più del 90% delle reazioni avverse cutanee è apparso nelle donne in un’età compresa tra 47-56 anni e il 75% delle reazioni cutanee sono state riportate in pazienti con una precedente storia dermatologica [4].
Ad oggi, è stato riportato un solo caso di EM dopo la vaccinazione BNT162b2 [8] mentre 3 casi sono noti dopo la prima somministrazione della prima dose di altro vaccino a mRNA [4].
Lavery et al. hanno riportato un caso di recidiva di EM dopo la vaccinazione BNT162b2 in una paziente di sesso femminile che era già affetta dalla malattia nel 2018 e che soffriva ricorrentemente di herpes labialis. Gli autori hanno riportato la presenza di placche eritematose su mani e piedi bilateralmente, ma l’assenza di coinvolgimento delle mucose [9].
EM rappresenta anche una possibile implicazione mucocutanea del Covid-19 stesso, specialmente nei bambini. I risultati istologici di queste lesioni hanno evidenziato la presenza di proteine SARS-COV-2 anche nelle cellule capillari endoteliali e nelle cellule epiteliali, insieme a una massiccia vasculite linfocitica helper CD4 + T e infiammazione dermica. Pochi casi di EM legati al Covid-19 sono stati riportati negli adulti [9,10,11], a volte presentandosi come la prima manifestazione prima di sintomi e segni respiratori [12].
I meccanismi fisiopatologici alla base delle lesioni osservate potrebbero essere correlati a una reazione di ipersensibilità linfocitaria cellulo-mediata con produzione di citochine pro-infiammatorie mirate agli antigeni SARS-COV‐ 2 localizzati nella pelle. L’infezione da Covid-19 è solitamente seguita da una massiccia risposta infiammatoria e da un enorme rilascio di citochine pro-infiammatorie, definito come “tempesta di citochine”, a causa di una risposta iper-immunitaria da parte dell’ospite che causa direttamente lesioni multi-organo ed eventualmente fallimento [13].
La vaccinazione potrebbe portare allo scoppio di EM a causa dell’espressione di un antigene sui cheratinociti, causando l’attivazione delle cellule T; un meccanismo già descritto per altre vaccinazioni (tetano e difterite, poliomielite inattivata ed Hemophilus b, vaiolo, vaccino contro l’epatite B) [14, 15].
L’EM potrebbe anche essere incidentale alla riattivazione dell’infezione da herpes simplex, che è una possibile reazione al vaccino BNT162b2.
La patogenesi dell’EM associata all’herpes è coerente con una reazione di ipersensibilità di tipo ritardato. La riattivazione di HSV-1 può essere correlata a un guasto della cella CD8 + T per mantenere la latenza. D’altra parte, la vaccinazione stimola il sistema immunitario e polarizza le cellule T [16].
Sahin et al. hanno riferito che il vaccino BNT162b2 ha indotto un’immunità adattativa umorale e cellulare coordinata [16]. Sette giorni dopo la prima dose, una forte risposta cellulare con cellule T CD8 + spike-specific e cellule T helper di tipo 1 (Th1) CD4 + T si sta espandendo con una produzione di interferone-γ (IFNγ), una citochina responsabile di diverse risposte antivirali [17].
Anticorpo legante la proteina spike (S1) presente dopo la prima dose, le risposte sono aumentate dopo la seconda dose; anticorpi neutralizzanti significativi (Nab) erano presenti solo dopo la seconda dose [18, 19].
Le risposte delle cellule T CD8 + spike-specifiche sono correlate positivamente con le IgG leganti S1, indicando uno sviluppo convergente dell’immunità adattativa umorale e cellulare.
Il cluster di queste cellule T CD8 + ha un fenotipo con bassa espressione di CCR7 e CD45RA e alta espressione di CD28 e CD27. Le cellule T CD8 + esprimono anche marcatori associati all’attivazione simile, come CD38, HLA244 DR e PD-1 [17].
HSV-1 stabilisce un’infezione latente a causa della persistenza delle cellule T CD8 + intorno alle cellule infette neuronali e gangli infette per tutta la vita. I marcatori CD69, CD44, CD25 e CD49d sono espressi sulla superficie delle cellule T CD8 + attivate. Sottoregolano i recettori di homing CD62L e CCR7 e i marcatori CD27 e CD28 delle cellule T CD8 + naïve.
Un eccesso di segnali in entrambe le direzioni potrebbe influenzare negativamente la popolazione di cellule T, portando a effettori esausti o memoria disfunzionale [17].
Durante la latenza HSV-1, le cellule T CD8 + inibiscono l’espressione genica di ICPO e ICP4 mediante la produzione di IFN-γ, granzimi A e B. Una disregolazione di questa regolazione dovuta a stress o cambiamenti ormonali può aumentare l’espressione dei geni litici, causando l’assemblaggio di componenti virali e il rilascio virale con una riattivazione clinica dell’infezione. Queste cellule T CD8 + non lasciano mai i gangli trigeminali: sopravvivono nel tessuto senza essere reintegrate da pool circolanti di cellule T CD8 + e mantengono un turn-over omeostatico [16].
Si possono immaginare diversi possibili meccanismi in base ai quali il numero di copie del genoma virale potrebbe influenzare la riattivazione dallo stato latente. Molte copie del genoma virale potrebbero effettivamente sopraffare i fattori che mettono a tacere la trascrizione del gene virale, portando ad una maggiore probabilità di riattivazione.
Tuttavia, questi nuovi casi non dimostrano la causalità e sono necessari ampi studi epidemiologici o sperimentali per evidenziare il possibile legame tra vaccinazione ed EM, attraverso la cross-reattività autoimmune dovuta alla riattivazione del virus dell’herpes (HSV-1).
LEGGI L’ARTICOLO: Oral erythema multiforme after Pfizer-BioNTech COVID-19 vaccination: a report of four cases | BMC Oral Health | Full Text (biomedcentral.com)