Migliaia di pubblicazioni scientifiche e casi clinici peer-reviewed da consultare
Il dottor Peter Doshi è professore associato di salute farmaceutica presso la University of Maryland School of Pharmacy, nonché redattore senior presso il British Medical Journal. “La sua ricerca si concentra sul processo di approvazione dei farmaci, su come vengono comunicati i rischi e i benefici dei prodotti medici e sul miglioramento della credibilità e dell’accuratezza della sintesi delle prove e delle pubblicazioni biomediche”.

Nella più recente riunione del comitato consultivo per i vaccini e i prodotti biologici correlati della Food and Drug Administration (FDA) negli Stati Uniti (6 aprile 2022), Doshi ha partecipato alla sessione di audizione pubblica aperta. È qui che i membri del pubblico possono presentare le proprie informazioni alla FDA. Il comitato si è riunito per discutere le considerazioni per l’uso dei richiami del vaccino COVID-19 e il processo per la selezione del ceppo vaccinale COVID-19 per affrontare le varianti attuali ed emergenti.
Il dottor Doshi ha riferito alla FDA di Brook Jackson, un informatrice di Ventavia, che ha condotto le sperimentazioni sui vaccini di Pfizer. Ha discusso di come sembra essersi verificato lo smascheramento dei partecipanti allo studio e di come ciò crei serie preoccupazioni sull‘integrità dei dati. Il Dr. Doshi ha inoltre sottolineato la mancanza di ispezioni da parte della FDA. Una trascrizione dei suoi commenti è qui sotto.
“Sono Peter Doshi, grazie per l’opportunità di parlare. Ai fini dell’identificazione, sono nella facoltà dell’Università del Maryland e un editore presso il BMJ. Non ho conflitti di interesse rilevanti e le mie osservazioni di oggi sono mie.
Lo scorso novembre, il BMJ ha riportato le rivelazioni di un informatrice di nome Brook Jackson, che lavorava per Ventavia, una società di ricerca a contratto che gestiva tre dei siti di sperimentazione clinica per il vaccino di Pfizer. Jackson ha affermato che la società aveva falsificato i dati, che i pazienti non erano in cieco, dell’impiego di vaccinatori non adeguatamente addestrati e della lentezza nel seguire gli eventi avversi. Ha fornito al BMJ e-mail aziendali, documenti interni, messaggi di testo, foto e registrazioni delle sue conversazioni con i dipendenti dell’azienda.

Questa foto, ad esempio, mostra materiali per il confezionamento dei vaccini che dovrebbero essere visti solo da personale non in cieco, lasciato aperto.

E lo smascheramento potrebbe essersi verificato su una scala molto più ampia. Qui potete vedere il documento contenente le istruzioni che lo staff di Ventavia ha ricevuto per archiviare la randomizzazione di ciascun partecipante allo studio e il foglio di conferma dell’assegnazione del farmaco nella tabella di ciascun partecipante. Conteneva informazioni non in cieco.
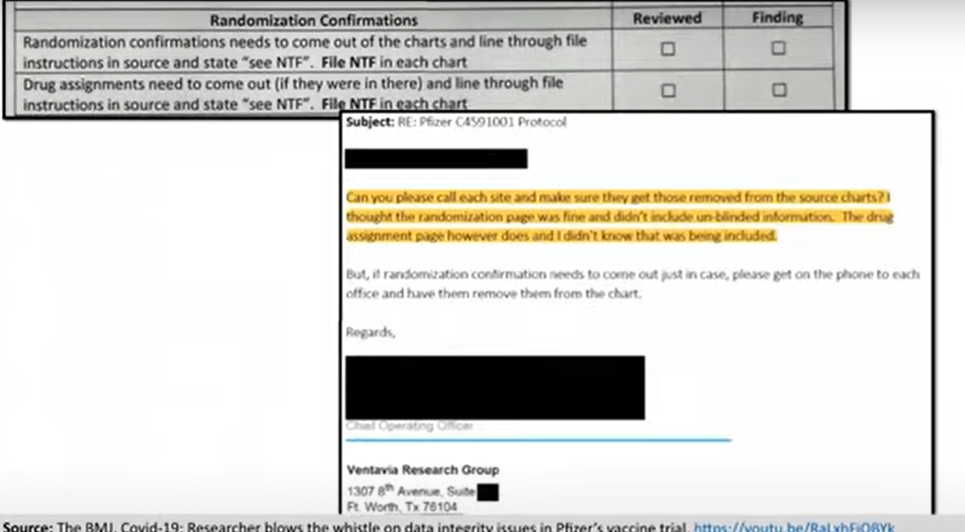
L’assenza di cieco, come penso tutti sappiano, crea serie preoccupazioni sull’integrità dei dati. Una volta scoperto questo enorme errore, Ventavia ha chiesto al personale di esaminare ogni singolo grafico per estrarre la randomizzazione e le conferme di assegnazione dei farmaci. Potete vedere qui un’e-mail del COO di Ventavia che reagisce dopo la scoperta del problema: non si erano nemmeno resi conto che la conferma dell’assegnazione del farmaco contenesse informazioni non in cieco.
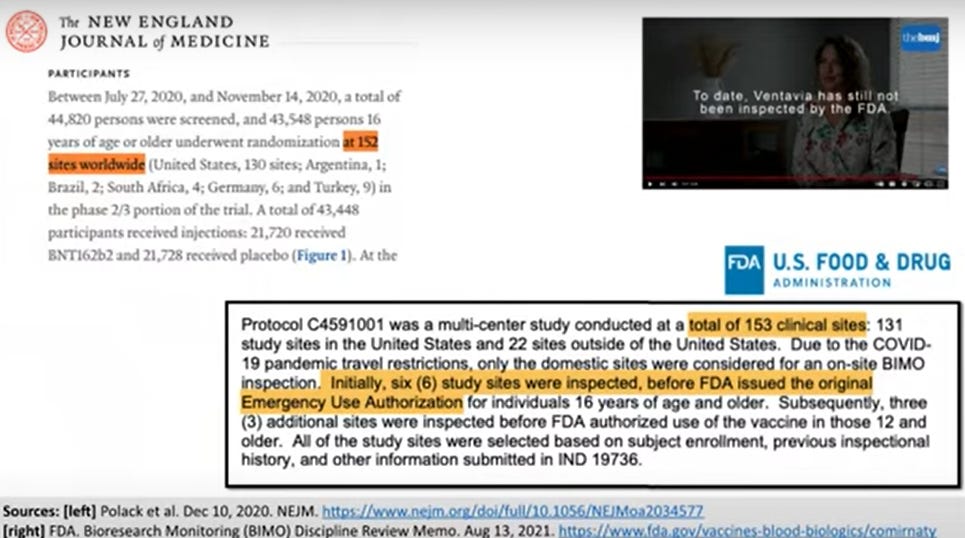
Nel vivo di una pandemia, non è difficile immaginare che siano stati commessi errori. Alcuni errori sono di poco conto, ma altri comportano gravi conseguenze per l’integrità dei dati. Si spera che il caso Ventavia sia un’anomalia estrema, ma abbiamo bisogno di qualcosa di più della semplice speranza. Abbiamo bisogno di prove che i dati siano stati trattati correttamente. Abbiamo bisogno di un controllo normativo. Ma nonostante la denuncia diretta dell’informatrice Brook Jackson alla FDA, la FDA non ha mai ispezionato Ventavia. In effetti, la FDA ha ispezionato solo 9 degli oltre 150 siti dello studio prima di approvare il vaccino. Solo 9 siti. E Pfizer continua a utilizzare Ventavia per le sperimentazioni.

E Moderna? La FDA ha avuto più di un anno e ha ispezionato solo uno – UNO – dei 99 siti dello studio.
Come può la FDA sentirsi sicura dei dati di Moderna basati su un campione dell’1%?
L’integrità dei dati richiede un’adeguata supervisione normativa. Una scienza affidabile richiede trasparenza dei dati. È passato più di un anno, ma i dati anonimi a livello di partecipante rimangono inaccessibili a medici, ricercatori e al pubblico. Il pubblico ha pagato per questi prodotti e il pubblico assume l’equilibrio tra benefici e danni dopo la vaccinazione. Il pubblico ha diritto alla trasparenza dei dati e la FDA ha l’obbligo di agire. Grazie“
Il video completo dell’incontro è qui sotto: